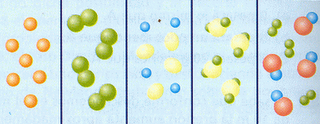
The Earth’s atmosphere is a mixture of gases called air. When it is not contaminated, air is
odourless, colourless and tasteless.
- Nitrogen (N2), 78%: this gas has no colour, no smell, and no taste.
- Oxygen (O2), 21%: it is in the air and water. Plants produce O2 during photosynthesis. It is necessary for combustion and respiration.
- Water vapour (H2Ov) and other gases, 0.97%: water vapour comes from the evaporation of oceans, lakes, and rivers and also from plants transpiration. Ozone (O3): It is another gas. Electrical storms and the interaction of the sun’s ultraviolet rays with oxygen produce O3.
- Carbon dioxide (CO2), 0.03%: this gas has no colour or smell and is soluble in water. It is produce by plant and animal respiration and the combustion of certain substances. It is essential for photosynthesis.
The
layers of the atmosphere
•IONOSPHERE. This layer is also
known as the THERMOSPHERE.
It
is the highest and the thickest layer. Its temperature increases to 1,000ºC due to X-rays and
gamma rays from the Sun.
It
reflects radio and television waves back to the Earth.
Comets
appear here.
•MESOSPHERE. About 40 km thick.
It
contains clouds of ice and dust.
•STRATOSPHERE. About 30 km thick.
There
is an increase in temperature from -70ºC at its lower limit to 0ºC at its higher limit.
The
ozone layer is here = ozonosphere. The ozone layer protects us from ultraviolet
rays.
•TROPOSPHERE. Very thin (it is 12 km thick), but contains
most of the
gases of
the atmosphere (80% of the total mass of the atmosphere).
Most meteorological phenomena occur here.
Atmospheric pressure
Air is matter: it has mass and weight
Atmospheric pressure = the weight of the atmosphere on the Earth
We do not notice atmospheric pressure because:
§
we have adapted to it.
§
it is equal in all directions.
Pressure can be measured.
The international unit
for pressure is the pascal (Pa). When we refer to atmospheric pressure we normally use the atmosphere (atm) or the millibar (mb)
1
atm = 1013 hPa = 1013 mb
Atmospheric
pressure varies with altitude
The lower layers support the weight of the upper layers. The gases here
are compressed and denser.Pressure at the top of a mountain is less than at he beach.
Normal pressure is the pressure at sea level (1 atm).
Pressure above this is high pressure.
Pressure below this is low pressure.
Atmospheric
pressure varies with temperature
The air moves from the areas of high pressure to the areas of low pressure, causing air currents.
Climate and Weather
The
most important meteorological instruments